Forschung
Untersuchungen zur Struktur und Funktion von photosynthetischen Proteinen in Eukaryoten
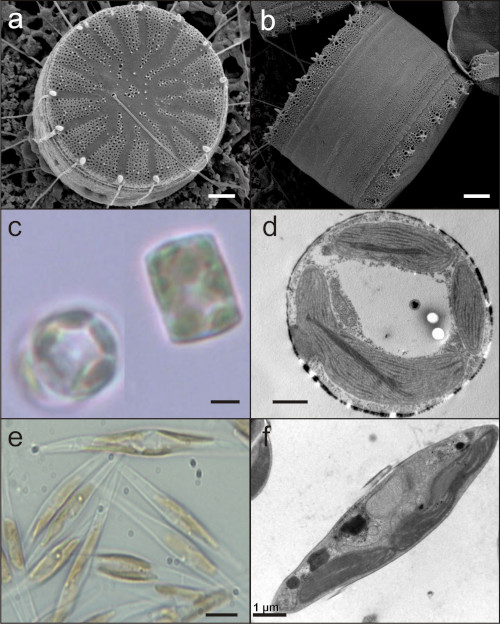
Die Arbeitsgruppe beschäftigt sich schwerpunktmäßig mit den molekularen Mechanismen der Anpassung von photosynthetischen Organismen an unterschiedliche Lichtbedingungen. Hierbei stehen Diatomeen (Kieselalgen) im Fokus.
Regulation der Lichtsammlung bei Diatomeen
Diatomeen sind einzellige, eukaryotische Algen, die aus zwei Gründen interessant sind: sie sind für ca. 25% der weltweiten Primärproduktion verantwortlich und stellen eine dauerhafte Kohlenstoffsenke im Bereich der Ozeane dar. Schwerpunkt sind Fragen zur Regulation der Lichtreaktionen der Photosynthese, vor allem zu dem effizienten und schnellen Umschalten von Lichtsammlung zu Lichtschutz. Letzteres ist für aquatische Organismen ohne eigene Fortbewegungsmöglichkeit extrem wichtig, und ein entscheidender Faktor für ihr großes Vorkommen z.B. im marinen Plankton. Diatomeen sind genetisch manipulierbar, so dass molekularbiologische Methoden zur Überexpression von getaggten Proteinen oder das Herunterfahren/Ausschalten der Expression eines bestimmten Gens (via RNAi oder CRISPR-Cas) von uns genutzt werden. Daneben werden allgemeine biochemische und spektroskopische Methoden verwendet, um die der Funktion zu Grunde liegende Struktur und die Zusammenarbeit der beteiligten Membranproteine aufzuklären. Zur Visualisierung der Struktur der Proteine dient auch die Elektronenmikroskopie.
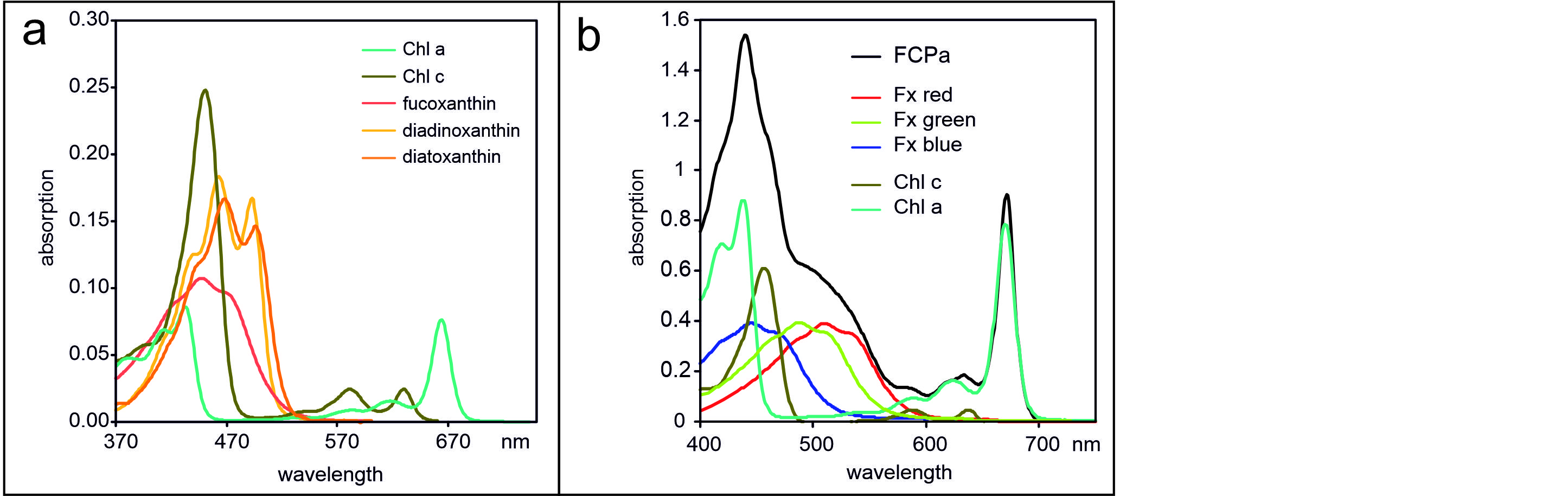
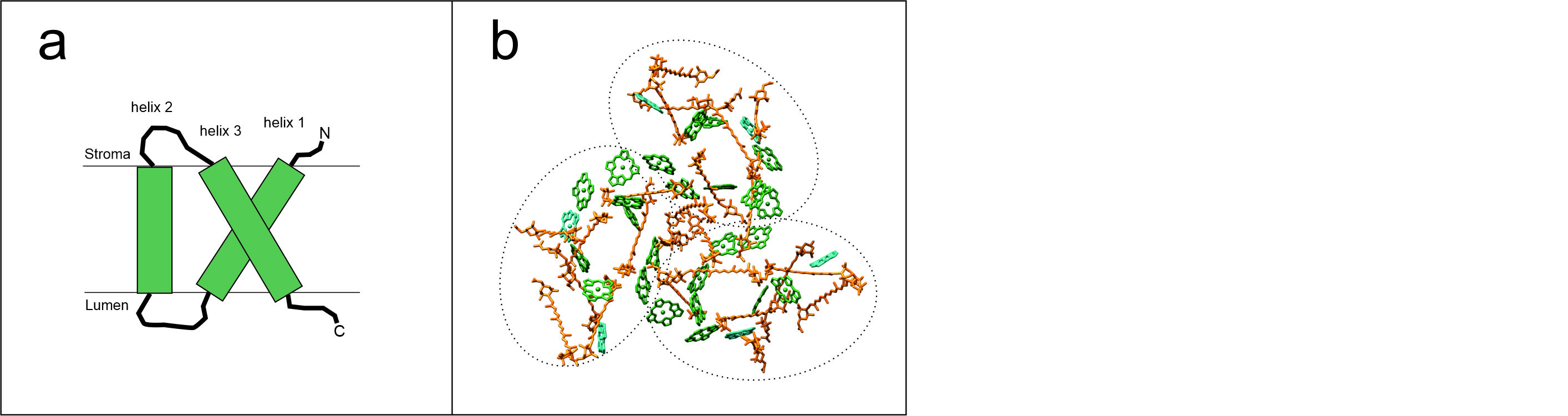
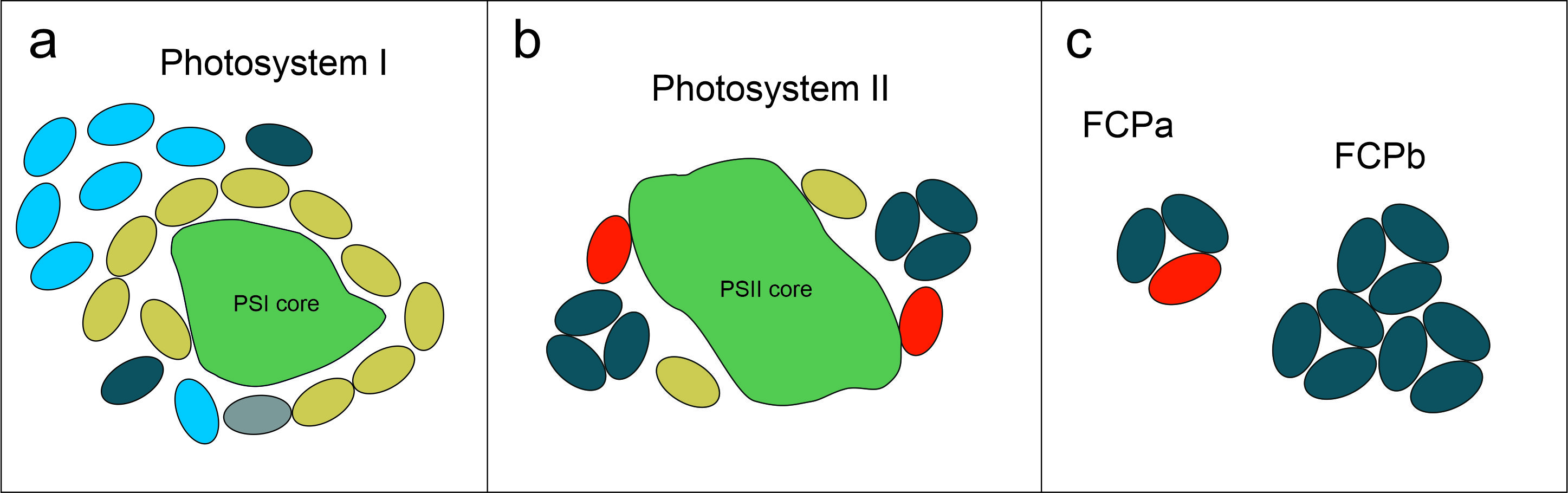
Organisation der Lichtsammelprotein
aus T. pseudonana und C. meneghiniana (verändert nach Arshad et al., 2021) im Photosystem I (a), Photosystem II (b) und in den freien FCP-Komplexen FCPa und FCPb, (c). Unterschiedliche Farben stehen für FCPs aus unterschiedlichen Familien.
Die Rolle von Photorezeptoren in der Lichtregulation von Diatomeen
Licht wird nicht nur zur Photosynthese genutzt, sondern wird auch über Rezeptoren zur Steuerung der Genexpression verwendet. Diatomeen besitzen Gene für verschiedene Cryptochrome, Proteine deren Funktion die DNA Reparatur oder besagte Rezeptorfunktion beinhaltet. In Diatomeen wurde von uns zum ersten Mal ein sogenanntes plant-like cryptochrome, CryP, entdeckt. Diese Gruppe von Cryptochromen wurde im Folgenden in vielen phylogenetischen Gruppen gefunden. CryP hat eine vielfältige Funktion in der Genregulation und aktuelle Arbeiten beschäftigen sich mit der Aufklärung des Signaltransduktionsweges.
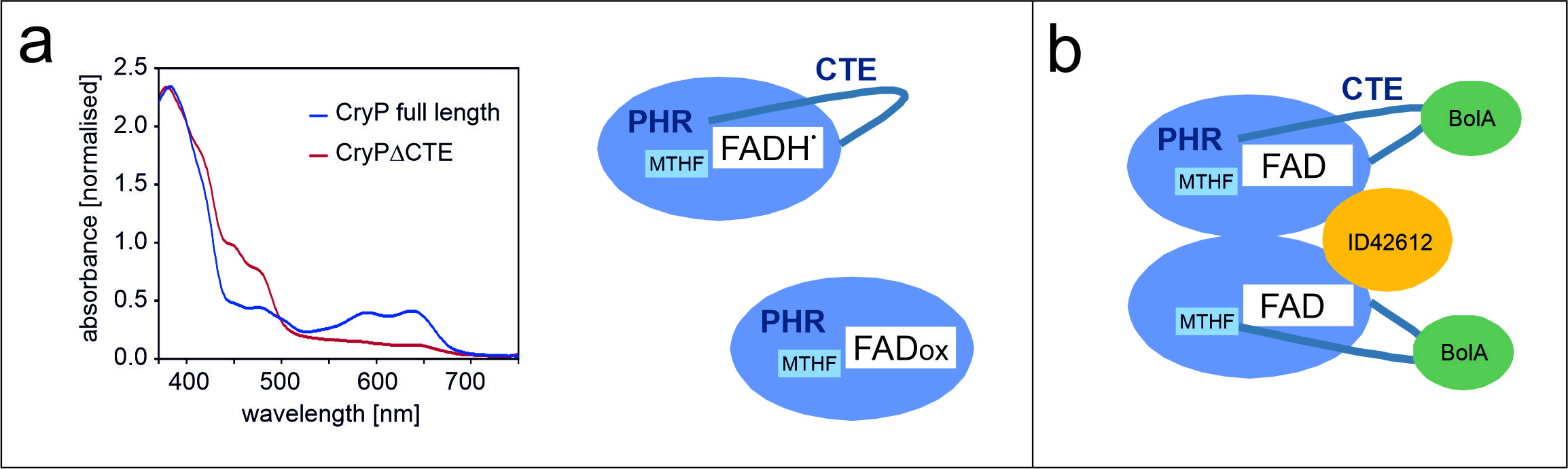
Eigenschaften von CryP. Der Redoxzustand des gebundenen FADs hängt von der Anwesenheit der C-terminalen Extension (CTE) ab (a). Als Dimer kann CryP zwei Proteine binden (b), ein Protein spezifisch für Diatomeen und einen Transkriptionsfaktor (BolA) (verändert nach Krischer et al. 2022).
Diatomeen in der Biotechnologie
Diatomeen sind zudem auf Grund ihrer hohen Lipidproduktion und der Anreicherung an mehrfach ungesättigten Fettsäuren biotechnologisch interessant. Weitere Projekte beschäftigten sich daher mit gentechnologischen Methoden zur Erhöhung der Triacylglyceridprodution bzw. der Produktion von 3-Omega-Fettsäuren.
Diese Projekte erfolg(t)en unterstützt durch Einzelprojektförderung der DFG, innerhalb einer Forschergruppe der DFG (Specific light driven reactions in unicellular model algae, FOR 1261) und einem Marie Curie Training and Research Network der EU, “Solar Energy to Biomass – Optimisation of light energy conversion in plants and microalgae- SE2B“ (http://www.uni-frankfurt.de/se2b), welches von uns koordiniert wurde. Zudem bestehen enge Kooperationen innerhalb und außerhalb der Universität (im Rahmen der genannten Kooperationsprojekte.
Kontakt
Pflanzliche Zellphysiologie
Prof. Dr. Claudia Büchel
Biozentrum, Campus Riedberg
Gebäudeteil 210, Raum 202
Max-von-Laue-Str. 9
60438 Frankfurt am Main
T +49 69 798-29602
F +49 69 798-29600
E c.buechel(at)bio.uni-frankfurt.de
Sekretariat
Susanne Horst
T +49 69 798-29601
E su.horst(at)bio.uni-frankfurt.de
 Our website in english
Our website in english
- Aktuelles und Presse
- Pressemitteilungen
- Öffentliche Veranstaltungen
- Uni-Publikationen
- Aktuelles Jahrbuch
- UniReport
- Forschung Frankfurt
- Aktuelle Stellenangebote
- Frankfurter Kinder-Uni
- Internationales
- Outgoings
- Erasmus / LLP
- Goethe Welcome Centre (GWC)
- Refugees / Geflüchtete
- Erasmus +
- Sprachenzentrum oder Fremdsprachen
- Goethe Research Academy for Early Career Researchers
- Forschung
- Research Support
- Forschungsprojekte, Kooperationen, Infrastruktur
- Profilbereich Molecular & Translational Medicine
- Profilbereich Structure & Dynamics of Life
- Profilbereich Space, Time & Matter
- Profilbereich Sustainability & Biodiversity
- Profilbereich Orders & Transformations
- Profilbereich Universality & Diversity





